El ensayo clínico del cannabis medicinal finalmente ha comenzado. El viernes 26 de marzo de 2021, la planta medicinal se prescribió por primera vez en el Hospital Universitario de Clermont-Ferrand. Dicho esto, ¿cómo se obtiene una receta de cannabis medicinal en Francia? ¿Y a dónde dirigirse? Estas son dos preguntas que se hacen muchas personas. Lo cual, en nuestra opinión, es perfectamente normal, ya que el cannabis, sus derivados, su posesión y su consumo están regulados. Por ello, en este artículo, queremos ofrecerle información que pueda arrojar luz sobre este tema. Índice
Sommaire
ToggleInformación sobre pacientes, indicaciones terapéuticas y prescripciones
- Enfoque en los productos y sus proveedores
- Seguridad del producto
- Enfoque en los centros de referencia
- Información sobre pacientes, indicaciones terapéuticas y prescripciones
¡No nos adelantemos! De hecho, al ser una novedad en Francia, seguramente se estará preguntando cuántos pacientes están involucrados, al menos inicialmente. CBD.FR también se ha planteado esta pregunta. En este sentido, nuestra investigación indica que el programa de ensayos clínicos de cannabis medicinal en Francia involucrará a 3000 pacientes durante un período de dos años. Esto es el resultado de las audiencias realizadas por la ANSM (Agencia Nacional Francesa para la Seguridad de los Medicamentos y Productos Sanitarios) para establecer los parámetros del programa. Es importante señalar que, para ser aceptados en el programa, los pacientes deben haber probado previamente varios tratamientos convencionales sin éxito y no deben presentar ninguna contraindicación.
Además, no se ha especificado un límite de edad. Sin embargo, estos pacientes no podrán conducir durante el período de prueba de dos años. ¿Por qué? Porque algunos medicamentos contienen THC.
Además, ¿qué hay de las indicaciones terapéuticas? En otras palabras, ¿qué enfermedades/afecciones se han seleccionado para este ensayo clínico de cannabis medicinal en Francia?
De hecho, el comité científico seleccionó un total de cinco (5) afecciones. Estas son: Espasticidad dolorosa asociada a trastornos del sistema nervioso central. Ciertas formas graves y farmacorresistentes de epilepsia.
- Situaciones de cuidados paliativos.
- Ciertos síntomas refractarios en oncología.
- Dolor neuropático que no responde a los tratamientos disponibles.
- Además, ¿cómo se ajustarán las recetas a los pacientes afectados? Dos puntos son esenciales a este respecto. En primer lugar, las recetas deben ser emitidas por médicos especializados en estas afecciones. En segundo lugar, los pacientes con sus recetas deben recoger sus productos a base de cannabis en las farmacias.
- Enfoque en los productos y sus proveedores
De hecho, se han seleccionado ciertas formas de cannabis. Estas incluyen, entre otras, aceite, flores y presentaciones orales. En este sentido, las proporciones relevantes son las siguientes: predominio de THC, predominio de CBD o una proporción equilibrada de THC/CBD. En este sentido, la ANSM (Agencia Nacional Francesa para la Seguridad de los Medicamentos y Productos Sanitarios) desaconseja el consumo de flores en forma de porros. En cambio, recomienda usarlos como infusiones.
¿Qué pasa con los proveedores? Como todos sabemos, el cultivo de cannabis medicinal sigue estando prohibido en Francia. Por consiguiente, la ANSM ha seleccionado empresas extranjeras para suministrar los productos necesarios para el ensayo de cannabis medicinal en Francia. Estas empresas proporcionarán los productos de forma gratuita mientras dure el programa. Nota sobre la seguridad de los productos: Los responsables del programa se aseguran de que todos los productos utilizados sean seguros para los pacientes. En este sentido, dos lotes de medicamentos ya han sido retirados del mercado debido a defectos de fabricación. La ANSM abordó este asunto en un comunicado de prensa del 2 de abril.
Se han notificado varios incidentes a la ANSM (Agencia Nacional Francesa para la Seguridad de los Medicamentos y Productos Sanitarios) relacionados con un defecto de calidad en la solución oral Tilray THC10 CBD10. Este defecto consiste en una fuga en el tapón del frasco. Medipha, la empresa que comercializa este medicamento para Tilray, está retirando del mercado los lotes afectados, que se encuentran en cuarentena a la espera de esta retirada. No se han dispensado frascos a ningún paciente. Se ha informado a los médicos y farmacéuticos que participan en el ensayo que ya no deben recetar ni dispensar los lotes afectados por la retirada. La disponibilidad de otros medicamentos permite que el ensayo continúe y garantiza la satisfacción de las necesidades de los pacientes.Centros de Referencia
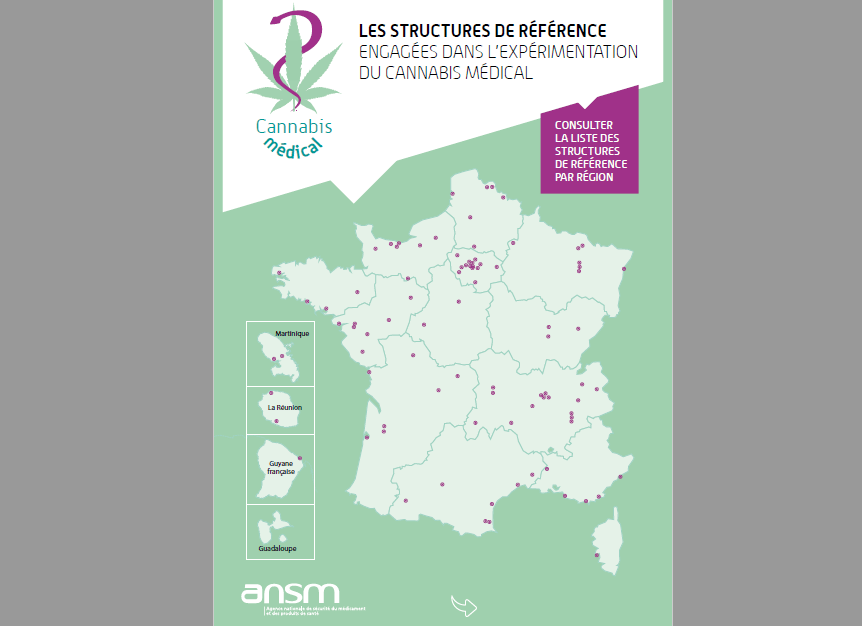
Se ha publicado una lista de 200 centros de referencia ubicados en 170 hospitales para facilitar el acceso a los pacientes que participan en este programa.
CBD.FR
también pone esta lista a disposición de sus lectores. Puede ver el mapa interactivo completo de centros de referencia a continuación. Si su dispositivo no lo permite, le invitamos a descargar su copia para su comodidad.
¿Desea descargar su copia? ¡Hazlo a continuación!
Lea también: Publicación del decreto que autoriza la experimentación con cannabis medicinal en Francia