Lasperimentazione della cannabis terapeutica è finalmente iniziata. Venerdì 26 marzo 2021, la pianta medicinale è stata prescritta per la prima volta presso l’Ospedale Universitario di Clermont-Ferrand. Detto questo, come si ottiene una prescrizione per la cannabis terapeutica in Francia?
Sommaire
ToggleE dove ci si deve rivolgere? Sono due domande che molti si pongono. Il che, a nostro avviso, è perfettamente normale. Perché la cannabis, i suoi derivati, il loro possesso e il loro utilizzo sono regolamentati. Pertanto, in questo articolo intendiamo fornirvi informazioni che possano fare luce su questo argomento.
- Indice
- Informazioni su pazienti, indicazioni terapeutiche e prescrizioni
- Focus sui prodotti e sui loro fornitori
Sicurezza dei prodotti
Focus sui centri di riferimento Informazioni su pazienti, indicazioni terapeutiche e prescrizioni Non corriamo troppo! Infatti, trattandosi di una prima assoluta in Francia, vi starete sicuramente chiedendo quanti pazienti siano coinvolti, almeno inizialmente. Anche CBD.FR si è posto questa domanda. A questo proposito, la nostra ricerca indica che il programma di sperimentazione della cannabis terapeutica in Francia coinvolgerà 3.000 pazienti nell’arco di due anni. Questo è il risultato delle audizioni condotte dall’ANSM (Agenzia Nazionale Francese per la Sicurezza dei Medicinali e dei Prodotti Sanitari) per stabilire i parametri del programma. È importante notare che, per essere ammessi al programma, i pazienti devono aver già provato diversi trattamenti convenzionali senza successo e non devono presentare controindicazioni.
Inoltre, non è stato specificato alcun limite di età. Tuttavia, a questi pazienti non sarà consentito guidare durante il periodo di sperimentazione di due anni. Perché? Perché alcuni farmaci contengono THC. Inoltre, che dire delle indicazioni terapeutiche? In altre parole, quali patologie/patologie sono state selezionate per questa sperimentazione sulla cannabis terapeutica in Francia?
- In effetti, il comitato scientifico ha selezionato un totale di cinque (5) condizioni. Queste sono:
- Spasticità dolorosa associata a disturbi del sistema nervoso centrale.
- Alcune forme gravi e farmacoresistenti di epilessia.
- Situazioni di cure palliative.
- Alcuni sintomi refrattari in oncologia.
Dolore neuropatico non responsivo ai trattamenti disponibili.
Inoltre, come funzioneranno le prescrizioni per i pazienti interessati? Due punti sono essenziali a questo proposito. In primo luogo, le prescrizioni devono essere redatte da medici specializzati in queste condizioni. In secondo luogo, i pazienti con le loro prescrizioni devono poi ritirare i prodotti a base di cannabis in farmacia.
E i fornitori? Come tutti sappiamo, la coltivazione di cannabis terapeutica è ancora vietata in Francia. Di conseguenza, l’ANSM ha selezionato aziende straniere per la fornitura dei prodotti necessari per la sperimentazione sulla cannabis terapeutica in Francia. Queste aziende forniranno i prodotti gratuitamente per tutta la durata del programma.Una nota sulla sicurezza dei prodotti: i responsabili del programma stanno garantendo che tutti i prodotti utilizzati siano sicuri per i pazienti. A questo proposito, due lotti di farmaci sono già stati ritirati dal mercato a causa di difetti di fabbricazione. L’ANSM ha affrontato la questione in un comunicato stampa del 2 aprile.
Sono stati segnalati all’ANSM (Agenzia Nazionale Francese per la Sicurezza dei Medicinali e dei Prodotti Sanitari) diversi incidenti riguardanti un difetto di qualità nella soluzione orale Tilray THC10 CBD10. Questo difetto riguarda una perdita dal tappo del flacone. Medipha, l’azienda che commercializza questo farmaco per Tilray, sta richiamando i lotti interessati, che sono stati messi in quarantena in attesa di questo richiamo. Nessun flacone è stato dispensato a nessun paziente. I medici e i farmacisti che partecipano alla sperimentazione sono stati informati che non devono più prescrivere o dispensare i lotti interessati dal richiamo. Altri farmaci disponibili consentono alla sperimentazione di proseguire e di garantire che le esigenze dei pazienti siano soddisfatte.
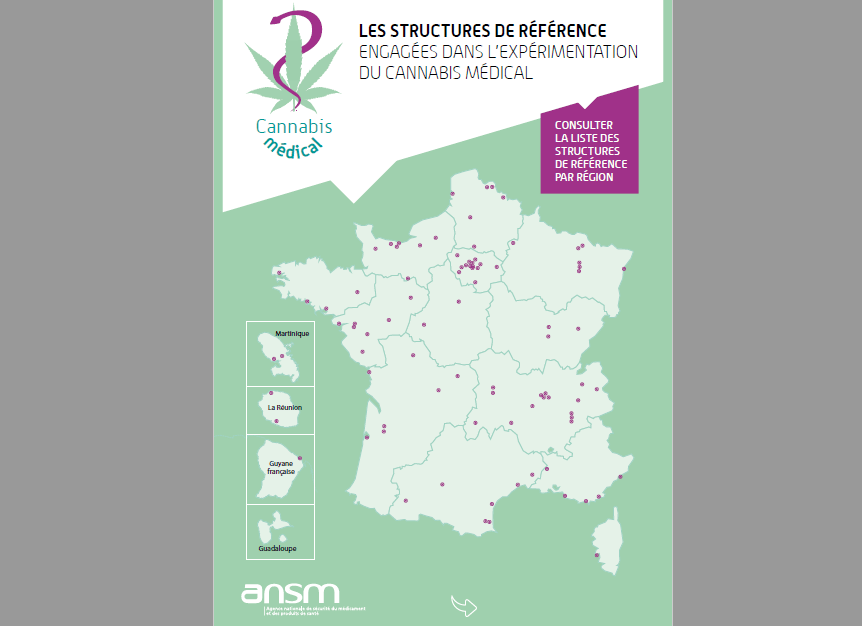
Focus sui Centri di Riferimento
È stato pubblicato un elenco di 200 centri di riferimento situati in 170 ospedali per facilitare l’accesso ai pazienti che partecipano a questo programma.
Vuoi scaricare la tua copia? Fallo qui sotto!
Leggi anche:Pubblicazione del decreto che autorizza la sperimentazione della cannabis terapeutica in Francia