DieStudie zu medizinischem Cannabis hat endlich begonnen. Am Freitag, dem 26. März 2021, wurde die Heilpflanze erstmals im Universitätsklinikum Clermont-Ferrand verschrieben. Doch wie bekommt man in Frankreich ein Rezept für medizinisches Cannabis?
Sommaire
ToggleUnd an wen wendet man sich? Diese beiden Fragen stellen sich viele. Und das ist unserer Meinung nach völlig verständlich. Denn Cannabis, seine Derivate, deren Besitz und Verwendung sind reguliert. In diesem Artikel möchten wir Ihnen daher Informationen zu diesem Thema bereitstellen.
- Inhaltsverzeichnis
- Informationen zu Patienten, therapeutischen Indikationen und Verschreibungen
- Fokus auf Produkte und ihre Lieferanten
Produktsicherheit
Fokus auf Überweisungszentren Informationen zu Patienten, therapeutischen Indikationen und Verschreibungen Aber warten wir es ab! Da dies ein Novum in Frankreich ist, fragen Sie sich sicherlich, wie viele Patienten – zumindest anfangs – beteiligt sind. Auch CBD.FR hat sich diese Frage gestellt. Unsere Recherchen deuten darauf hin, dass das klinische Studienprogramm für medizinisches Cannabis in Frankreich über einen Zeitraum von zwei Jahren 3.000 Patienten umfassen wird. Dies ist das Ergebnis von Anhörungen der französischen Arzneimittelbehörde ANSM (Nationale Agentur für die Sicherheit von Arzneimitteln und Gesundheitsprodukten) zur Festlegung der Programmparameter. Wichtig ist, dass Patienten, um in das Programm aufgenommen zu werden, bereits mehrere konventionelle Behandlungen erfolglos ausprobiert haben und keine Kontraindikationen aufweisen dürfen.
Es gibt keine Altersbegrenzung. Während der zweijährigen Studienphase dürfen die Patienten jedoch kein Fahrzeug führen. Der Grund dafür ist, dass einige Medikamente THC enthalten. Welche therapeutischen Indikationen wurden für diese klinische Studie zu medizinischem Cannabis in Frankreich ausgewählt?
- Tatsächlich wurden vom wissenschaftlichen Komitee insgesamt fünf (5) Krankheitsbilder ausgewählt:
- Schmerzhafte Spastik im Zusammenhang mit Erkrankungen des zentralen Nervensystems;
- Bestimmte schwere und medikamentenresistente Formen von Epilepsie;
- Palliativmedizinische Situationen;
- Bestimmte therapieresistente Symptome in der Onkologie;
Neuropathische Schmerzen, die auf verfügbare Behandlungen nicht ansprechen.
Wie funktioniert die Verschreibung für die betroffenen Patienten? Zwei Punkte sind hierbei wesentlich: Erstens müssen die Rezepte von Ärzten ausgestellt werden, die auf diese Krankheitsbilder spezialisiert sind. Zweitens müssen die Patienten ihre Cannabisprodukte mit dem Rezept in Apotheken abholen.
Fokus auf die Produkte und ihre Lieferanten: Es wurden bestimmte Cannabisprodukte ausgewählt, darunter Öl, Blüten und orale Darreichungsformen. Die relevanten Verhältnisse sind: überwiegend THC, überwiegend CBD oder ein ausgewogenes THC/CBD-Verhältnis. Die französische Arzneimittelbehörde ANSM (Nationale Agentur für die Sicherheit von Arzneimitteln und Gesundheitsprodukten) rät vom Konsum der Blüten in Form von Joints ab. Stattdessen wird die Anwendung als Infusion empfohlen. Wie sieht es mit den Lieferanten aus? Bekanntlich ist der Anbau von medizinischem Cannabis in Frankreich weiterhin verboten. Daher hat die ANSM ausländische Unternehmen ausgewählt, die die für die Studie zu medizinischem Cannabis in Frankreich benötigten Produkte liefern. Diese Unternehmen stellen die Produkte während der gesamten Programmdauer kostenlos zur Verfügung.
Hinweis zur Produktsicherheit: Die Verantwortlichen des Programms stellen sicher, dass alle verwendeten Produkte für die Patienten sicher sind. In diesem Zusammenhang wurden bereits zwei Medikamentenchargen aufgrund von Herstellungsfehlern zurückgerufen. Die ANSM äußerte sich in einer Pressemitteilung vom 2. April zu diesem Thema.„Der französischen Arzneimittelbehörde ANSM wurden mehrere Vorfälle im Zusammenhang mit einem Qualitätsmangel der Tilray-Lösung THC10 CBD10 gemeldet. Dieser Mangel betrifft ein Leck am Flaschenverschluss. Medipha, das Unternehmen, das dieses Medikament für Tilray vertreibt, ruft die betroffenen Chargen zurück. Diese wurden bis zum Abschluss des Rückrufs unter Quarantäne gestellt. Es wurden noch keine Flaschen an Patienten ausgegeben. Ärzte und Apotheker, die an der Studie teilnehmen, wurden darüber informiert, dass sie die vom Rückruf betroffenen Chargen nicht mehr verschreiben oder abgeben dürfen. Dank anderer verfügbarer Medikamente kann die Studie fortgesetzt werden, und die Versorgung der Patienten wird sichergestellt.“
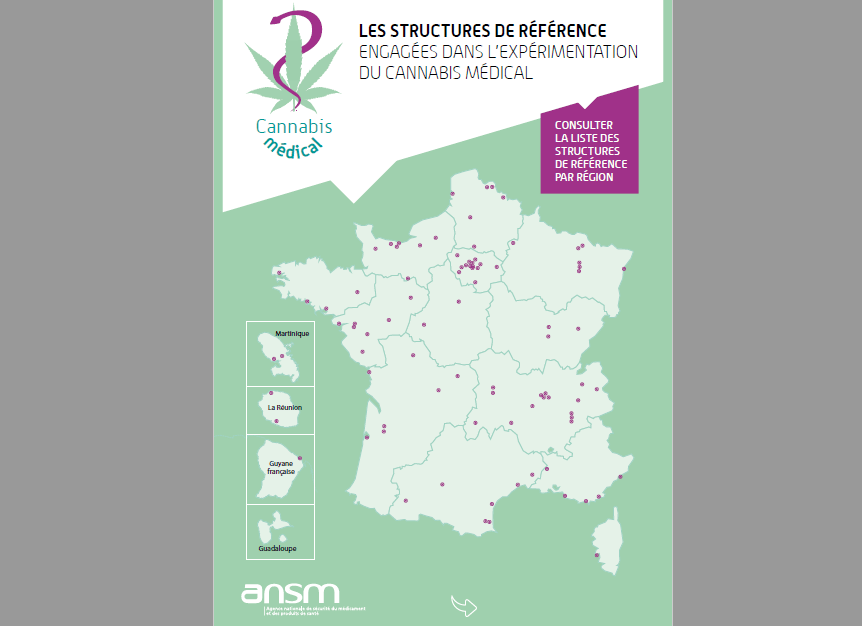
Fokus auf Referenzzentren
Eine Liste mit 200 Referenzzentren in 170 Krankenhäusern wurde veröffentlicht, um den Zugang für die Teilnehmer dieses Programms zu erleichtern.
CBD.FR stellt diese Liste ebenfalls seinen Lesern zur Verfügung. Sie können die vollständige interaktive Karte der Referenzzentren unten einsehen. Falls Ihr Gerät dies nicht zulässt, können Sie die Liste gerne herunterladen.
Sie möchten die Liste herunterladen? Dann klicken Sie unten!